Քիմիական ռեակցիաները բազմաթիվ են ու բազմաբնույթ: Մի շարք ընդհանուր հատկությունների համաձայն, քիմիական ռեակցիաները հնարավոր է դասակարգել, որը բավական դյուրացնում է նրանց ուսումնասիրությունը:
Ըստ սկզբնանյութերի և վերջանյութերի թվի ու բաղադրության՝ ռեակցիաները լինում են.
- միացման
- քայքայման
- տեղակալման
- փոխանակման
Միացման քիմիական ռեակցիայի ժամանակ երկու կամ ավելի նյութերից ստացվում է մեկ բարդ նյութ:
Միացման ռեակցիայի ելանյութերը կարող են լինել ինչպես պարզ, այնպես էլ բարդ նյութեր: Օրինակ, երկու բարդ նյութերի՝ կալցիումի օքսիդի և ջրի փոխազդեցությունից ստացվում է մեկ ավելի բարդ նյութ՝ կալցիումի հիդրօքսիդ:
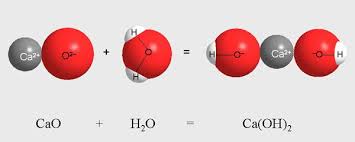
Կալցիումի օքսիդի և ջրի միացման ռեակցիան
Երկու պարզ նյութերի՝ ալյումինի և յոդի փոխազդեցությունից առաջանում է մեկ բարդ նյութ՝ ալյումինի յոդիդ:


Ալյումինի և յոդի միացման ռեակցիան
2Al+3J2=2AlJ3
Քայքայման ռեակցիայի ժամանակ մեկ բարդ նյութի քայքայումից ստացվում են երկու կամ ավելի նյութեր:
Ստացվող նյութերը կարող են լինել և՛բարդ, և՛ պարզ: Օրինակ, մեկ բարդ նյութից՝ պղնձի (II) հիդրոքսիդի քայքայումից առաջանում են երկու բարդ նյութ՝ պղնձի (II) օքսիդ և ջուր:

Պղնձի (II) հիդրոքսիդի քայքայումը
Cu(OH)2=CuO+H2O
Մեկ բարդ նյութի՝ ջրի քայքայումից առաջանում են երկու պարզ նյութ՝ջրածին և թթվածին:

Ջրի քայքայումը
2H2O=2H2+O2
Տեղակալման է պարզ և բարդ նյութերի միջև ընթացող այն քիմիական ռեակցիան, որի ժամանակ պարզ նյութը կազմող ատոմները տեղակալում են բարդ նյութի բաղադրությունում առկա տարրերից որևէ մեկի ատոմները:Օրինակ, պարզ նյութ՝ ցինկի և բարդ նյութ աղաթթվի փոխազդեցությունից առաջանում են նոր պարզ նյութ՝ ջրածին և բարդ նյութ՝ ցինկի քլորիդ:

Ցինկի և աղաթթվի փոխազդեցությունը.
Գործնական մաս
Քայքայման ռեակցիաներ`
Մալաքիտի ջերմային քայքայումը
Սարքավորումներ` Լաբորատոր կալան, փորձանոթ, սպիրտայրոց, լուցկի, գազատար խողովակ ունեցող խցան, կոլբ
Մենք դասարանում կատարեցինք քիմիական ռեակցիայի քայքայման տեսակի փորձ։
Ինչպես գիտենք քայքայման ռեակցիայի ժամանակ մեկ բարդ նյութից ստացվում են երկու կամ երկուսից ավել նյութեր։
Փորձի բնութագիր և ընթացք․
Փորձանոթը հորիզոնական դիրքով ամրացրեք լաբորատոր կալանի թաթին:Գազատար խողովակիծայրն իջեցրեք կրաջուր պարունակող բաժակի մեջ ու մալաքիթը տաքացրեք: Կանաչ փոշին վերածվում է սև փոշու, իսկ փորձանոթի պատերին ջրի կաթիլներ են հայտնվում:
Գազատար խողովակից դուրս եկող գազը պղտորում է կրաջուրը, ինչը հաստատում է, որ քայքայումից առաջացել է նաև ածխածնի (IV) օքսիդ (CO2):
Cu2CH2O5= 2CuO+H2O+CO2